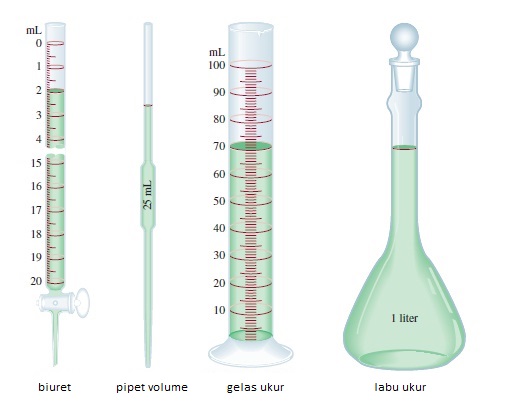
Pengukuran digunakan seorang ahli kimia untuk mendapatkan data. Instrumen memungkinkan kita untuk mengukur sifat zat, misalnya meteran, buret, pipet, labu ukur dan pipet volume (Gambar 1.8) serta neraca analitik dan termometer. Instrumen ini memberikan hasil pengukuran sifat makroskopik, yang dapat ditentukan secara langsung. Sifat mikroskopik, pada skala atom atau molekul, harus ditentukan dengan metode tidak langsung, seperti yang akan kita bahas kemudian pada bab 2.
Suatu kuantitas yang diukur biasanya ditulis sebagai bilangan dengan satuan yang sesuai. Untuk mengatakan bahwa jarak antara Palangka Raya dan Sampit dengan mobil sepanjang rute tertentu adalah 227 km. Kita harus menentukan bahwa jarak tempuhnya 227 kilometer. Hal yang sama berlaku juga dalam kimia. Satuan sangat penting untuk menyatakan pengukuran dengan benar.
Selama bertahun-tahun, para ilmuwan mencatat pengukuran dalam satuan metrik, dalam bentuk desimal atau pun pangkat dari 10. Pada tahun 1960, konferensi internasional dilaksanakan untuk menyepakati satuan, mengusulkan sistem metrik perlu direvisi kemudian disebut Sistem Satuan Internasional (disingkat SI). Tabel 1.3 menunjukkan tujuh satuan pokok SI. Semua satuan lain pengukuran dapat diturunkan dari satuan pokok tersebut. Seperti satuan metrik, satuan SI yang dimodifikasi dalam mode desimal dengan serangkaian prefiks, seperti yang ditunjukkan pada Tabel 1.4 Kita akan menggunakan keduanya, baik satuan metrik maupun satuan SI.
Pengukuran yang kita akan sering manfaatkan dalam penelitian kimia meliputi waktu, massa, volume, densitas (kerapatan), dan suhu.
Tabel 1.3 Satuan Pokok SI
Kuantitas Dasar
|
Satuan
|
Simbol
|
Panjang
|
Meter
|
m
|
Massa
|
Kilogram
|
kg
|
Waktu
|
Detik
|
s
|
Arus listrik
|
Amper
|
A
|
Suhu
|
Kelvin
|
K
|
Jumlah zat
|
Mol
|
mol
|
Intensitas cahaya
|
Kandela
|
cd
|
Tabel 1.4 Prefiks yang digunakan pada satuan pokok SI
Prefiks
|
Simbol
|
Nilai
|
Contoh
|
Tera-
|
T
|
1.000.000.000.000 atau
1012
|
1 terameter (Tm) = 1
x 1012m
|
Giga-
|
G
|
1.000.000.000 atau
109
|
1 gigameter (Gm) = 1
x 109m
|
Mega-
|
M
|
1.000.000 atau 106
|
1 megameter (Mm) = 1
x 106m
|
Kilo-
|
k
|
1.000 atau 103
|
1 kilometer (km) = 1
x 103m
|
Desi-
|
d
|
1/10 atau 10-1
|
1 desimeter (dm) = 1
x 10-1m
|
Senti-
|
c
|
1/100 atau 10-2
|
1 sentimeter (cm) =
1 x 10-2m
|
Mili-
|
m
|
1/1000 atau 10-3
|
1 milimeter (mm) = 1
x 10-3m
|
Mikro-
|
µ
|
1/1.000.000 atau 10-6
|
1 mikrometer (µm) =
1 x 10-6m
|
Nano-
|
n
|
1/1.000.000.000 atau
10-9
|
1 nanometer (nm) = 1
x 10-9m
|
Pico-
|
p
|
1/1.000.000.000.000 atau
10-12
|
1 picometer (pm) = 1
x 10-12m
|
Massa dan Berat
Istilah "massa" dan "berat" sering digunakan secara bergantian, meskipun telah ditegaskan keduanya berbeda. Massa adalah ukuran dari jumlah materi dalam suatu objek, sedangkan berat secara teknis, adalah gaya gravitasi yang diberikannya pada objek. Apel yang jatuh dari pohon ditarik ke bawah oleh gravitasi bumi. Massa apel adalah kuantitas tetap dan tidak tergantung pada lokasi, tetapi berat tergantung pada nilai gaya gravitasi lokasi objek. Sebagai contoh, pada permukaan bulan apel akan memiliki berat hanya seperenam dari beratnya di Bumi, karena gaya gravitasi di permukaan bulan hanya seperenam dari gaya gravitasi permukaan bumi. Gravitasi bulan yang lebih kecil memungkinkan astronot untuk melompat lebih bebas pada permukaannya. Ahli kimia tertarik terutama pada massa, yang dapat ditentukan dengan mudah dengan neraca. Proses pengukuran massa, anehnya sering disebut berat (kurang tepat).
Gambar 1.9 Protipe kilogram terbuat dari paduan logam platina-iridium. Disimpan dalam lemari besi di International Bureau of Weights And Measures di Sevres, Prancis. Pada tahun 2007 ditemukan bahwa paduan logam ini secara misterius telah kehilangan massa 50 mg.
Contoh:
Disuatu lokasi tertentu yang memiliki percepatan gravitasi (g) 9,8 m/s2 sepotong batangan emas memiliki berat (W) 98 N. Massa (m) sepotong batangan emas tersebut dihitung dengan rumus W= m x g diperoleh nilai m = 10 g.
Satuan SI untuk massa adalah kilogram (kg), satuan panjang adalah meter (m) dan satuan waktu adalah detik (s). Peristiwa alam dapat diukur berulang oleh para ilmuwan di mana saja. Kilogram ditetapkan dalam hal objek tertentu (Gambar 1.9). Dalam kimia satuan yang lebih kecil gram (g) lebih nyaman digunakan karena untuk penelitian kimia perlu biaya yang mahal:
1 kg = 1000 g = 1 × 103 g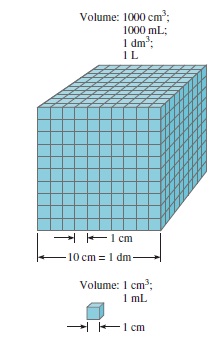 |
| Gambar 1.10 Volume |
Satuan SI untuk panjang adalah meter (m), dan satuan SI yang diturunkan untuk volume adalah meter kubik (m3). Umumnya, ahli kimia bekerja dengan volume yang lebih kecil, seperti sentimeter kubik (cm3) dan desimeter kubik (dm3):
1 cm3 = (1x 10-2
m)3 = 1 x 10-6 m3
1 dm3 = (1x 10-1 m)3
= 1 x 10-3 m3Satuan lain yang umum untuk volume adalah liter (L). Satu liter adalah volume yang ditempati oleh satu desimeter kubik (dm3). Satu liter volume sama dengan 1.000 mililiter (mL) atau 1.000 cm3:
1 L = 1000
mL
= 1000
cm3
= 1 dm3
dan satu mililiter sama dengan satu sentimeter kubik:1 mL = 1 cm3
Gambar 1.10 membandingkan ukuran relatif dari dua volume. Meskipun liter (L) bukan satuan SI, volume biasanya dinyatakan dalam liter dan mililiter.
Massa jenis atau densitasPersamaan untuk massa jenis
di mana d, m, dan V masing-masing menunjukkan densitas, massa, dan volume. Karena densitas (massa jenis zat) adalah sifat intensif dan tidak tergantung pada kuantitas massa, untuk zat tertentu, rasio massa berbanding volume selalu tetap sama; dengan kata lain, V meningkat jika m meningkat. Densitas biasanya berubah dengan perubahan suhu.
Satuan SI yang diturunkan untuk massa jenis zat adalah kilogram per meter kubik (Kg/m3). Satuan ini agak besar untuk sebagian besar penerapan atau penelitian kimia. Oleh karena itu, gram per sentimeter kubik (g/cm3) yang setara dengan gram per mililiter (g/mL), yang lebih umum digunakan untuk massa jenis padat dan cair. Karena massa jenis gas seringkali sangat rendah, kita mengungkapkannya dalam satuan gram per liter (g/L):
1
g/cm3 = 1
g/mL = 1000 kg/m3
1 g/L = 0,001 g/mLTabel 1.5 Daftar massa jenis beberapa zat
Zat
|
Densitas
(g/cm3)
|
etanol
|
0,79
|
air
|
1,00
|
raksa
|
13,6
|
natrium klorida
|
2,2
|
besi
|
7,9
|
emas
|
19,3
|
Skala Suhu
Ada tiga skala suhu yang umum digunakan yaitu satuan °F (derajat Fahrenheit), °C (derajat Celcius), dan K (Kelvin). Skala Fahrenheit merupakan skala yang paling umum digunakan di Amerika Serikat di luar laboratorium, menentukan titik beku dan titik didih normal air persis 32°F dan 212 °F. Skala Celsius membagi rentang antara titik beku air (0 °C) dan titik didih (100 °C). Tabel 1.3 menunjukkan, kelvin adalah satuan dasar SI untuk suhu: merupakan skala suhu mutlak. Mutlak berarti bahwa nol pada skala Kelvin, dilambangkan dengan 0 K, adalah suhu terendah yang dapat dicapai secara teoritis. Di sisi lain, 0°F dan 0°C didasarkan pada perilaku air. Gambar 1.11 membandingkan tiga skala suhu.
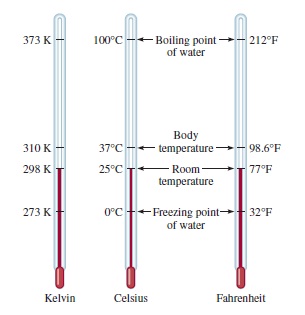 |
| Gambar 1.11 Perbandingan dari tiga skala suhu, yaitu Celsius, Fahrenheit, dan skala mutlak Kelvin. Perhatikan bahwa ada 100 divisi, atau 100 derajat, antara titik beku dan titik didih air pada skala Celsius, dan ada 180 divisi, atau 180 derajat, antara dua batas suhu yang sama pada skala Fahrenheit. Skala Celsius sebelumnya disebut skala Centigrade. |
Ukuran derajat pada skala Fahrenheit hanya 100/180, atau 5/9, dari tingkat pada skala Celsius. Untuk mengkonversi derajat Fahrenheit ke derajat Celsius, kita tuliskan
Persamaan berikut digunakan untuk mengkonversi derajat Celsius ke derajat Fahrenheit:
Baik Celcius maupun Kelvin memiliki satuan yang sama besarnya, yaitu satu derajat Celsius setara dengan satu Kelvin. Penelitian eksperimental telah menunjukkan bahwa nol mutlak pada skala Kelvin setara dengan -273,15°C pada skala Celsius. Dengan demikian, kita dapat menggunakan persamaan berikut untuk mengkonversi derajat Celsius ke Kelvin:
Kita akan sering menjumpai konversi antara derajat Celcius dan derajat Fahrenheit serta antara derajat Celsius dan Kelvin.