Setelah mempelajari beberapa satuan yang digunakan dalam bidang kimia, sekarang kita beralih ke teknik untuk menangani bilangan yang terkait dengan hasil pengukuran, yaitu: notasi ilmiah dan angka signifikan (disebut juga dengan angka pasti).
Notasi Ilmiah
Ahli kimia sering menangani bilangan yang sangat besar atau sangat kecil. Misalnya, dalam 1 g unsur hidrogen kira-kira ada sekitar 602.200.000.000.000.000.000.000 atom hidrogen. Setiap atom hidrogen memiliki massa kira-kira 0,00000000000000000000000166 g
Angka-angka ini tidak praktis untuk ditangani. Seorang ahli kimia mudah untuk membuat kesalahan saat menggunakannya dalam perhitungan aritmatika jika kurang teliti. Pertimbangkan perkalian berikut ini:
0,0000000056 × 0,00000000048 = 0,000000000000000002688
Mudah bagi kita melewatkan satu angka nol atau menambahkan satu angka nol lagi setelah tanda koma secara tidak sengaja atau karena kurang teliti. Akibatnya, ketika bekerja dengan bilangan sangat besar dan sangat kecil, kita menggunakan sistem yang disebut notasi ilmiah. Terlepas dari besarnya, semua angka bisa dinyatakan dalam bentuk berikut:
N x 10n
dimana N adalah bilangan antara 1 sampai 10 dan n adalah eksponennya atau pangkatnya yang merupakan bilangan bulat positif atau bilangan bulat negatif. Sejumlah angka yang diungkapkan dengan cara ini disebut dan ditulis dalam notasi ilmiah.
Misalkan kita diberi bilangan tertentu dan diminta untuk mengungkapkannya dalam notasi ilmiah. Pada dasarnya, tugas ini meminta kita untuk menemukan n. Kita harus menghitung jumlah tempat dimana tanda koma harus dipindahkan untuk memberi bilangan N (yaitu antara 1 sampai 10). Jika tanda koma harus dipindahkan ke kiri, maka n adalah bilangan bulat positif. Jika tanda koma harus dipindahkan ke kanan, maka n adalah bilangan bulat negatif. Contoh berikut menggambarkan penggunaan notasi ilmiah:
(1) Ungkapkan bilangan 568,762 dalam notasi ilmiah:
568,762 = 5,68762 × 102
Perhatikan bahwa tanda koma dipindahkan ke kiri melewati dua tempat (dua angka disebelahnya) dan n = 2.
(2) Ungkapkan bilangan 0,00000772 dalam notasi ilmiah:
0,00000772 = 7,72 × 10–6
Di sini tanda koma dipindahkan ke kanan melewati enam tempat dan n = -6.
Harus diingat dua hal berikut ini! Pertama, n = 0 digunakan untuk bilangan yang tidak dinyatakan dalam notasi ilmiah. Misalnya, 74,6 × 100 (n = 0) setara dengan 74,6. Kedua, praktik yang biasa dilakukan adalah menghilangkan superskrip (indeks atas) ketika n = 1. Dengan demikian, notasi ilmiah untuk 74,6 adalah 7,46 × 10 dan bukan 7,46 × 101.
Selanjutnya, kita mempertimbangkan bagaimana notasi ilmiah ditangani dalam operasi aritmatika.
Penjumlahan dan pengurangan
Untuk menjumlahkan atau mengurangi menggunakan notasi ilmiah, pertama-tama kita menulis setiap kuantitas - misalkan N1 dan N2 - dengan eksponen n yang sama. Kemudian kita menjumlahkan N1 dan N2; eksponennya tetap sama. Perhatikan contoh berikut ini:
(7,4 x 103) + (2,1 x 103)
= 9,5 x 103
(4,31 x 104) + (3,9 x 103)
= (4,31 x 104) + (0,39 x 104) = 4,70 x 104
(2,22 x 1022)
- (4,10 x 1023) = (2,22 x 1022) - (0,41 x 1022)
= 1,81 x 1022
Perkalian dan Pembagian
Untuk mengalikan angka yang dinyatakan dalam notasi ilmiah, kita mengalikan N1 dan N2 dengan cara biasa, tetapi untuk eksponennya dijumlahkan. Untuk membagi dengan notasi ilmiah, kita membagi N1 dan N2 seperti biasa tetapi eksponennya dikurangkan. Contoh berikut menunjukkan bagaimana operasi ini dilakukan agar lebih jelas:
Angka Signifikan atau Angka Pasti
Kecuali bila semua angka yang terlibat adalah bilangan bulat (misalnya, dalam menghitung jumlah mahasiswa di kelas), seringkali tidak mungkin untuk mendapatkan nilai pasti dari kuantitas yang diteliti. Untuk alasan ini, penting untuk menunjukkan margin kesalahan dalam pengukuran dengan menunjukkan secara jelas jumlah angka signifikan atau angka pasti, yang merupakan angka bermakna dalam jumlah yang diukur atau dihitung. Bila angka signifikan digunakan, angka terakhir dipahami sebagai angka tidak pasti. Sebagai contoh, kita bisa mengukur volume sejumlah cairan dengan menggunakan gelas ukur (gelas yang terbuka dibagian atas dan digunakan untuk mengukur volume suatu cairan secara akurat, gelas ukur juga dikenal sebagai measuring cylinder) dengan skala yang memberi ketidakpastian 1 mL dalam pengukuran. Jika volumenya yang diukur 6 mL, maka volume sebenarnya berada pada kisaran 5 mL sampai 7 mL. Kita menuliskan volume cairan sebagai (6±1) mL. Dalam kasus ini, hanya ada satu angka signifikan atau angka pasti (angka 6), sedangkan angka yang tidak pasti diwakili oleh plus-minus 1 mL. Untuk keakuratan yang lebih besar, kita bisa menggunakan pipet ukur yang memiliki divisi yang lebih baik, sehingga volume yang kita ukur sekarang ketidakpastiannya hanya 0,1 mL. Jika volume cairan sekarang ditemukan 6,0 mL, kita dapat menyatakan jumlahnya sebagai (6,0± 0,1) mL, dan nilai sebenarnya adalah antara 5,9 mL dan 6,1 mL. Kita dapat lebih meningkatkan alat pengukur dan memperoleh angka yang lebih signifikan, namun dalam setiap kasus, angka terakhir selalu tidak pasti. Angka ketidakpastian ini tergantung pada alat ukur yang kita gunakan.
Gambar 1.12 Neraca Analitik
Gambar 1.12 menunjukkan neraca atau timbangan modern. Neraca seperti ini tersedia di banyak laboratorium kimia pada umumnya. Neraca ini dengan mudah mengukur massa benda dengan empat tempat desimal. Oleh karena itu, massa terukur biasanya memiliki empat angka yang signifikan (misalnya 0,8642 g) atau lebih (misalnya 3,9745 g). Menjaga jumlah angka signifikan dalam pengukuran seperti massa memastikan bahwa perhitungan yang melibatkan data akan mempengaruhi ketepatan pengukuran.
Pedoman untuk Menggunakan Angka Signifikan atau Angka Pasti
Kita harus selalu berhati-hati dalam karya ilmiah untuk menuliskan jumlah angka signifikan (angka pasti) yang tepat. Secara umum, cukup mudah untuk menentukan berapa banyak angka signifikan dengan mengikuti aturan berikut:
- Setiap angka yang bukan nol signifikan. Dengan demikian, 845 cm memiliki tiga angka signifikan, 1,234 kg memiliki empat angka signifikan, dan seterusnya.
- Angka nol di antara angka bukan nol signifikan. Dengan demikian, 606 m berisi tiga angka signifikan, 40,501 kg mengandung lima angka signifikan, dan seterusnya.
- Angka nol di sebelah kiri angka bukan nol pertama tidak signifikan. Tujuannya adalah untuk menunjukkan penempatan koma desimal. Sebagai contoh, 0,08 L berisi satu angka signifikan, 0,0000349 g berisi tiga angka signifikan, dan seterusnya.
- Jika angka lebih besar dari 1, maka semua angka nol yang ditulis di sebelah kanan koma dianggap sebagai angka signifikan. Dengan demikian, 2,0 mg memiliki dua angka signifikan, 40,062 mL memiliki lima angka signifikan, dan 3,040 dm memiliki empat angka signifikan. Jika angka kurang dari 1, maka hanya angka nol yang ada di akhir angka dan angka nol yang berada di antara angka bukan nol yang sigifikan. Ini berarti bahwa 0,090 kg memiliki dua angka signifikan, 0,3005 L memiliki empat angka signifikan, 0,00420 mL memiliki tiga angka signifikan, dan seterusnya.
- Untuk angka yang tidak mengandung koma, angka nol yang tertinggal (yaitu angka nol setelah angka nol terakhir) boleh signifikan atau boleh tidak signifikan. Jadi, 400 cm boleh memiliki satu angka signifikan (angka 4), dua angka signifikan (40), atau tiga angka signifikan (400). Kita tidak bisa mengetahui mana yang benar tanpa informasi lebih lanjut. Dengan menggunakan notasi ilmiah kita dapat menghindari ambiguitas ini. Dalam kasus khusus ini, kita dapat mengungkapkan angka 400 sebagai 4 × 102 untuk satu angka signifikan, 4,0 × 102 untuk dua angka signifikan, atau 4,00 × 102 untuk tiga angka signifikan.
Perangkat aturan kedua menentukan bagaimana menangani angka signifikan dalam perhitungan.
1.Untuk penjumlahan dan pengurangan, jawabannya tidak dapat memiliki lebih banyak angka di sebelah kanan koma daripada angka mula-mula. Pertimbangkan contoh berikut ini:
89,332
1,1______+
90,432 (dibulatkan menjadi 90,43)
2,097
0,12
______-
1,977 (dibulatkan menjadi 1,98)
2.Prosedur pembulatan adalah sebagai berikut. Untuk membulatkan sebuah angka pada koma tertentu, kita cukup meletakan angka yang mengikuti jika yang pertamanya kurang dari 5 maka angka terakhir dihilangkan. Jadi, 8,724 dibulatkan ke 8,72, jika kita hanya menginginkan dua angka setelah koma. Jika angka pertama setelah koma pembulatan sama dengan atau lebih besar dari 5, kita tambahkan 1 ke angka sebelumnya dan menghilangkan angka terakhir. Dengan demikian, 8,727 dibulatkan ke 8,73, dan 0,425 dibulatkan ke 0,43.
Dalam perkalian dan pembagian, jumlah angka signifikan dalam hasil akhir atau hasil bagi dapat ditentukan oleh jumlah asal yang memiliki jumlah terkecil dari angka signifikan. Contoh berikut menggambarkan aturan ini:
2,8 x 4,5039 = 12,610926,85 : 112,04 = 0,0611388789
3. Harus diingat bahwa angka pasti yang diperoleh dari definisi atau dengan menghitung jumlah objek dapat dianggap memiliki jumlah angka yang signifikan. Misalnya, inci didefinisikan sama dengan 2,54 sentimeter tepat, yaitu:
1 inci = 2,54 cm
Dengan demikian, "2,54" dalam persamaan tidak boleh ditafsirkan sebagai angka terukur dengan tiga angka signifikan. Dalam perhitungan yang melibatkan konversi antara "inci" dan "cm," kita memperlakukan keduanya "1" dan "2,54" memiliki jumlah angka yang signifikan. Begitu pula jika sebuah benda memiliki massa 5,0 g, maka massa dari sembilan benda tersebut adalah
5,0 g x 9 = 45 g
Jawabannya memiliki dua angka signifikan karena 5,0 g memiliki dua angka signifikan. Angka 9 tepat dan tidak menentukan jumlah angka yang signifikan. Contoh pada Latihan 1.5 menunjukkan bagaimana angka signifikan ditangani dalam operasi aritmatika
Prosedur pembulatan sebelumnya berlaku untuk perhitungan satu langkah. Dalam perhitungan berantai, yaitu perhitungan yang melibatkan lebih dari satu langkah, kita bisa mendapatkan jawaban yang berbeda tergantung pada bagaimana kita membulatkan. Pertimbangkan perhitungan dua langkah berikut ini:
Langkah 1 : A x B = C
Langkah 2 : C x D = E
Anggaplah A = 3,66, B = 8,45, dan D = 2,11. Bergantung pada apakah kita membulatkan C ke tiga atau empat angka signifikan, kita memperoleh bilangan yang berbeda untuk E:
Cara 1:3,66 x 8,45 = 30,9
30,9 x 2,11 = 65,2
Cara 2:
3,66 x 8,45 = 30,93
30,9 x 2,11 = 65,3
Namun, jika kita telah melakukan perhitungan seperti ini 3,66 x 8,45 x 2,11 pada kalkulator tanpa membulatkan jawaban antara, kita akan mendapatkan 65,3 sebagai jawaban untuk E. Meskipun mempertahankan angka tambahan melewati jumlah angka signifikan untuk langkah-langkah antara membantu menghilangkan kesalahan dari pembulatan, prosedur ini tidak diperlukan untuk sebagian besar perhitungan karena perbedaan antara jawaban biasanya cukup kecil. Oleh karena itu, untuk sebagian besar contoh dan masalah diakhir bab dimana jawaban antara dicantumkan, semua jawaban, antara dan akhir, akan dibulatkan.
Akurasi dan Presisi
Dalam membahas pengukuran dan angka signifikan, berguna untuk membedakan antara akurasi dan presisi (ketepatan). Akurasi memberi tahu kita seberapa dekat pengukuran dengan nilai sebenarnya dari kuantitas yang diukur. Bagi seorang ilmuwan ada perbedaan antara akurasi dan presisi. Presisi (ketepatan) mengacu pada seberapa dekat dua atau lebih pengukuran dengan angka yang sama saling mendukung satu sama lain (Gambar 1.13).
Perbedaan antara akurasi dan presisi (ketepatan) adalah perbedaan yang tipis (sulit dibedakan) tetapi penting. Misalkan, bahwa tiga siswa diminta untuk menentukan massa sepotong kawat tembaga. Hasil dua penimbangan berturut-turut oleh masing-masing siswa tersebut sebagai berikut:
Massa sebenarnya dari kawat adalah 2,000 g. Oleh karena itu, hasil Siswa B lebih tepat daripada nilai Siswa A, namun tidak ada hasil yang sangat akurat. Hasil Siswa C tidak hanya yang paling tepat, tapi juga yang paling akurat, karena nilai rata-rata paling dekat dengan nilai sebenarnya. Pengukuran yang sangat akurat biasanya juga tepat. Di sisi lain, pengukuran yang sangat presisi tidak menjamin hasil yang akurat. Misalnya, tongkat meter atau neraca yang tidak dikalibrasi dengan benar dapat mengakibatkan pembacaan presisi yang salah.
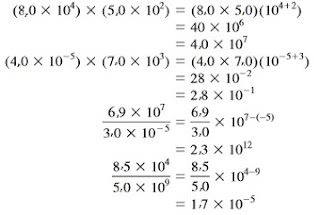



No comments:
Post a Comment
Note: Only a member of this blog may post a comment.