Pada abad kelima masehi, seorang filsuf Yunani bernama Democritus menyatakan keyakinannya bahwa semua materi terdiri dari partikel-partikel yang sangat kecil dan tidak dapat dibagi lagi, yang ia beri nama atomos (yang berarti tidak dapat dibagi atau tidak dapat dipecah/hancur). Meskipun gagasan Democritus tidak diterima oleh banyak orang sezamannya (terutama Plato dan Aristoteles), entah bagaimana pendapat itu tetap bertahan. Bukti eksperimental dari penyelidikan ilmiah awal abad delapan belas memberikan dukungan untuk gagasan "atomisme", kemudian secara bertahap memunculkan definisi modern unsur dan senyawa. Pada tahun 1808, seorang ilmuwan dan guru sekolah Inggris bernama John Dalton memformulasikan definisi yang tepat tentang satuan penyusun materi yang tidak dapat dibagi lagi yang disebut atom.
Karya Dalton menandai awal dari era kimia modern. Hipotesis tentang sifat materi yang menjadi dasar teori atom Dalton dapat diringkas sebagai berikut:
- Unsur-unsur tersusun dari partikel-partikel sangat kecil yang disebut atom.
- Semua atom dari unsur yang sama adalah identik, memiliki ukuran, massa, dan sifat kimia yang sama. Atom-atom suatu unsur berbeda dari atom-atom unsur lainnya.
- Senyawa tersusun atas atom-atom lebih dari satu unsur. Dalam senyawa apa pun, rasio jumlah atom dari dua unsur yang ada adalah bilangan bulat sederhana.
- Reaksi kimia hanya melibatkan pemisahan, kombinasi, atau penataan ulang atom; atom tidak dapat diciptakan ataupun dihancurkan.
Gambar 2.1 adalah representasi skematis dari tiga hipotesis terakhir.
Konsep Dalton tentang atom jauh lebih rinci dan spesifik daripada pendapat Democritus. Hipotesis kedua menyatakan bahwa atom dari suatu unsur berbeda dari atom unsur lainnya. Dalton tidak berusaha menggambarkan struktur atau komposisi atom — dia tidak tahu seperti apa atom itu sebenarnya. Tetapi ia menyadari bahwa sifat-sifat berbeda yang ditunjukkan oleh unsur-unsur seperti hidrogen dan oksigen dapat dijelaskan dengan mengasumsikan bahwa atom-atom hidrogen tidak sama dengan atom-atom oksigen. Hipotesis ketiga menunjukkan bahwa, untuk membentuk senyawa tertentu, tidak hanya membutuhkan atom dari jenis unsur yang tepat, tetapi juga sejumlah atom tertentu.
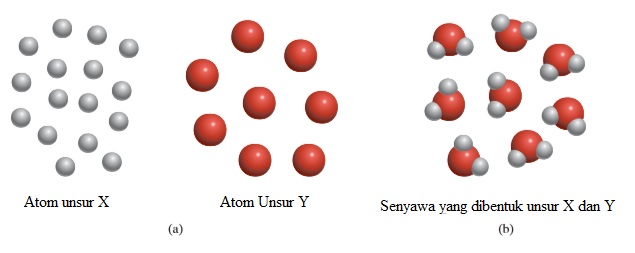
Gambar 2.1 (a) Menurut teori atom Dalton, atom dari unsur yang sama adalah identik, tetapi atom dari suatu unsur berbeda dengan atom semua unsur lainnya. (b) Senyawa terbentuk dari atom unsur X dan Y. Dalam hal ini, rasio atom unsur X dan atom unsur Y adalah 2:1. Perhatikan bahwa reaksi kimia hanya menghasilkan penataan ulang atom, bukan dalam penghancuran atau penciptaannya.
Ide ini merupakan perpanjangan dari hukum yang diterbitkan pada tahun 1799 oleh Joseph Proust, seorang ahli kimia dari Perancis. Hukum Proust tentang proporsi pasti atau dikenal dengan hukum perbandingan tetap menyatakan bahwa sampel yang berbeda dari senyawa yang sama selalu mengandung unsur-unsur penyusunnya dalam proporsi yang sama berdasarkan massa. Jadi, jika dianalisis sampel gas karbon dioksida yang diperoleh dari sumber yang berbeda, akan ditemukan dalam setiap sampel rasio yang sama antara massa karbon terhadap oksigen. Maka dapat dipastikan, bahwa, jika rasio massa unsur-unsur yang berbeda dalam senyawa tertentu adalah tetap, maka rasio atom-atom unsur-unsur ini dalam senyawa juga harus tetap.
Hipotesis ketiga Dalton mendukung hukum penting lainnya, hukum proporsi berganda atau hukum perbandingan berganda. Menurut hukum ini, jika dua unsur dapat bergabung membentuk lebih dari satu senyawa, massa dari satu unsur yang bergabung dengan massa tetap dari unsur lainnya berada dalam rasio bilangan bulat sederhana. Teori Dalton menjelaskan hukum perbandingan berganda cukup sederhana: Senyawa berbeda yang terdiri dari unsur-unsur yang sama berbeda dalam jumlah atom dari setiap jenis yang bergabung. Sebagai contoh, karbon membentuk dua senyawa stabil dengan oksigen, yaitu karbon monoksida dan karbon dioksida. Teknik pengukuran modern menunjukkan bahwa satu atom karbon bergabung dengan satu atom oksigen dalam karbon monoksida dan dengan dua atom oksigen dalam karbon dioksida. Dengan demikian, rasio oksigen dalam karbon monoksida terhadap oksigen dalam karbon dioksida adalah 1:2. Hasil ini konsisten dengan hukum perbandingan berganda (Gambar 2.2).
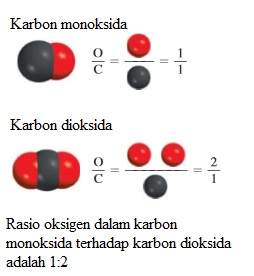
Gambar 2.2 Ilustrasi hukum perbandingan berganda.
Hipotesis keempat Dalton adalah cara lain untuk menyatakan hukum kekekalan massa, yaitu bahwa materi tidak dapat diciptakan ataupun dimusnahkan. Karena materi tersusun dari atom yang tidak berubah selama reaksi kimia, maka massanya juga harus tetap. Pandangan jenius Dalton tentang sifat materi adalah stimulus utama bagi kemajuan pesat kimia selama abad kesembilan belas.
No comments:
Post a Comment
Note: Only a member of this blog may post a comment.