Kimiawan menggunakan rumus kimia untuk mengekspresikan komposisi molekul dan senyawa ionik dalam simbol kimia. Dengan komposisi yang dimaksud bukan hanya unsur-unsur yang ada tetapi juga rasio-rasio di mana atom-atom digabungkan. Di sini perhatian pada dua jenis rumus, yaitu: rumus molekul dan rumus empiris.
Rumus Molekul
Rumus molekul menunjukkan jumlah atom yang pasti dari setiap unsur dalam satuan terkecil suatu senyawa. Dalam diskusi tentang molekul, setiap contoh senyawa diberikan dengan rumus molekulnya dalam tanda kurung. Dengan demikian, H2 adalah rumus molekul untuk hidrogen, O2 adalah oksigen, O3 adalah ozon, dan H2O adalah air. Angka subskrip menunjukkan jumlah atom dari suatu unsur yang ada. Tidak ada subskrip untuk O dalam H2O karena hanya ada satu atom oksigen dalam molekul air, jadi angka “satu” dihilangkan dari rumus. Perhatikan bahwa oksigen (O2) dan ozon (O3) adalah alotrop oksigen. Alotrop adalah salah satu dari dua atau lebih bentuk unsur yang molekulnya berbeda. Dua bentuk alotrop dari unsur karbon — intan dan grafit — secara dramatis berbeda tidak hanya dalam sifat tetapi juga dalam harga relatifnya.
Model Molekul
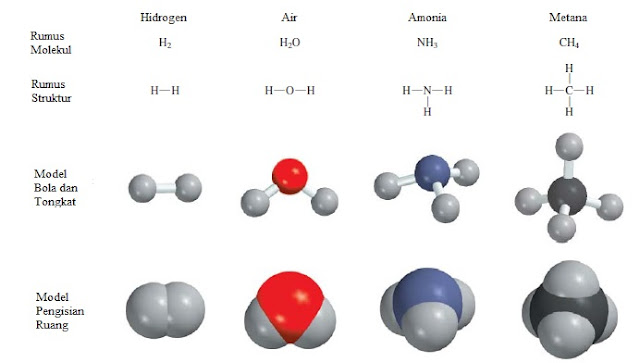
Molekul terlalu kecil untuk kita amati secara langsung. Cara yang efektif untuk memvisualisasikannya adalah dengan menggunakan model molekul. Dua tipe standar model molekul yang digunakan saat ini, yaitu: model bola-tongkat dan model pengisian-ruang (Gambar 2.12). Dalam kit model bola-tongkat, atom-atom adalah bola kayu atau plastik dengan lubang di dalamnya. Tongkat atau pegas digunakan untuk mewakili ikatan kimia. Sudut-sudut yang dibentuk antara atom mendekati sudut ikatan dalam molekul yang sebenarnya. Dengan pengecualian atom H, semua bola memiliki ukuran yang sama dan setiap jenis atom diwakili oleh warna tertentu. Dalam model pengisian-ruang, atom diwakili oleh bola terpotong yang disatukan dengan pengencang jepret, sehingga ikatan tidak terlihat. Bola sebanding dengan ukuran atom. Langkah pertama menuju pembuatan model molekul adalah menulis rumus struktur, yang menunjukkan bagaimana atom terikat satu sama lain dalam sebuah molekul. Sebagai contoh, diketahui bahwa masing-masing dari dua atom H terikat pada atom O dalam molekul air. Oleh karena itu, rumus struktur air adalah H-O-H. Garis yang menghubungkan dua simbol atom melambangkan ikatan kimia.
Model bola-tongkat menunjukkan susunan atom tiga dimensi dengan jelas, dan model ini cukup mudah untuk dibangun. Namun, bola tidak sebanding dengan ukuran atom. Selanjutnya, tongkat sangat melebih-lebihkan ruang antara atom dalam sebuah molekul. Model pengisian ruang lebih akurat karena model ini menunjukkan variasi dalam ukuran atom. Kelemahan model ini adalah bahwa membangunnya memakan waktu untuk disatukan dan model ini tidak menunjukkan posisi atom tiga dimensi dengan sangat baik. Kita akan menggunakan kedua model secara ekstensif dalam pembahasan selanjutnya.
Gambar 2.12 Rumus Molekul, rumus struktur, dan model molekul dari empat molekul umum.
Rumus Empiris
Rumus molekul hidrogen peroksida (zat yang digunakan sebagai antiseptik dan sebagai zat pemutih untuk tekstil dan rambut) adalah H2O2. Rumus ini menunjukkan bahwa setiap molekul hidrogen peroksida terdiri dari dua atom hidrogen dan dua atom oksigen. Rasio atom hidrogen dan atom oksigen dalam molekul ini adalah 2:2 atau disedernakan menjadi 1:1. Rumus empiris hidrogen peroksida adalah HO. Dengan demikian, rumus empiris memberi informasi tentang unsur-unsur yang ada dan rasio bilangan bulat paling sederhana dari atom-atomnya, tetapi belum tentu menunjukan jumlah atom yang sebenarnya dalam molekul tertentu. Sebagai contoh lain, perhatikan senyawa hidrazin (N2H4) yang digunakan sebagai bahan bakar roket. Rumus empiris hidrazin adalah NH2. Meskipun rasio nitrogen terhadap hidrogen adalah 1:2 pada kedua rumus molekul (N2H4) dan rumus empiris (NH2), hanya rumus molekul yang memberi tahu jumlah atom N (dua) dan H (empat) yang sebenarnya ada dalam molekul hidrazin.
Rumus empiris adalah rumus kimia paling sederhana; rumus ini ditulis dengan menyderhanakan angka subskrip (indeks bawah) dalam rumus molekul menjadi bilangan bulat terkecil yang mungkin. Rumus molekul adalah rumus molekul yang sebenarnya. Jika kita mengetahui rumus molekul, maka kita juga mengetahui rumus empiris, tetapi sebaliknya belum tentu benar. Lalu mengapa para ahli kimia repot-repot dengan rumus empiris? Seperti yang akan kita lihat di Bab 3, ketika ahli kimia menganalisis suatu senyawa yang tidak diketahui, langkah pertama biasanya adalah menentukan rumus empiris senyawa tersebut. Dengan informasi tambahan, dimungkinkan untuk menyimpulkan rumus molekul.
Untuk sebagian besar molekul, rumus molekul dan rumus empiris adalah satu dan sama. Beberapa contohnya adalah air (H2O), amonia (NH3), karbon dioksida (CO2), dan metana (CH4).
Contoh 2.2 dan 2.3 berurusan dengan penulisan rumus molekul dari model molekul dan penulisan rumus empiris dari rumus molekul.
Contoh 2.2
Tuliskan rumus molekul metanol, pelarut organik dan antibeku, dari model bola-tongkat, yang ditunjukkan di bawah ini.
Metanol
Penyelesaian
Lihat label (lihat juga sebelah belakang). Ada empat atom H, satu atom C, dan satu atom O. Oleh karena itu, rumus molekulnya adalah CH4O. Namun, cara standar penulisan rumus molekul untuk metanol adalah CH3OH karena ini menunjukkan bagaimana atom bergabung dalam molekul.
Contoh 2.3
Tuliskan rumus empiris untuk molekul-molekul berikut: (a) asetilena (C2H2), yang digunakan dalam obor las; (b) glukosa (C6H12O6), suatu zat yang dikenal sebagai gula darah; dan (c) dinitrogen oksida (N2O), gas yang digunakan sebagai gas anestesi (“gas tertawa”) dan sebagai propelan aerosol untuk krim kocok.
Strategi
Ingat bahwa untuk menulis rumus empiris, subskrip dalam rumus molekul harus dikonversi menjadi bilangan bulat terkecil yang mungkin.
Solusi
(a) Ada dua atom karbon dan dua atom hidrogen dalam asetilena. Membagi subskrip dengan 2, kita memperoleh rumus empiris CH.
(b) Dalam glukosa ada 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen. Membagi subskrip dengan 6, kita memperoleh rumus empiris CH2O. Perhatikan bahwa jika kita membagi subskrip dengan 3, maka akan mendapatkan rumus C2H4O2. Meskipun rasio karbon terhadap atom hidrogen dan oksigen dalam C2H4O2 sama dengan C6H12O6 (1: 2: 1), C2H4O2 bukanlah rumus yang paling sederhana karena subskripnya tidak berada dalam rasio angka terkecil.
(c) Karena subskrip dalam N2O sudah merupakan bilangan bulat terkecil, rumus empiris untuk dinitrogen oksida sama dengan rumus molekulnya.
Rumus Senyawa Ionik
Rumus senyawa ionik biasanya sama dengan rumus empirisnya karena senyawa ionik tidak terdiri dari satuan molekul diskrit. Sebagai contoh, sampel padat natrium klorida (NaCl) terdiri dari jumlah ion Na+ dan Cl- yang sama yang diatur dalam jaringan tiga dimensi (Gambar 2.13). Dalam senyawa seperti itu ada rasio 1:1 kation terhadap anion sehingga senyawa tersebut netral secara elektrik. Seperti yang dapat dilihat pada Gambar 2.13, tidak ada ion Na+ dalam NaCl yang dikaitkan hanya dengan satu ion Cl- tertentu. Bahkan, setiap ion Na+ sama-sama dipegang oleh enam ion Cl- sekitarnya dan sebaliknya. Dengan demikian, NaCl adalah rumus empiris untuk natrium klorida. Dalam senyawa ionik lainnya, struktur yang sebenarnya mungkin berbeda, tetapi pengaturan kation dan anion sedemikian rupa sehingga semua senyawa netral secara elektrik. Perhatikan bahwa muatan pada kation dan anion tidak ditampilkan dalam rumus untuk senyawa ionik.
Gambar 2.13 (a) Struktur NaCl padat. (b) Pada kenyataannya, kation kontak dengan anion. Dalam kedua (a) dan (b), bola yang lebih kecil mewakili ion Na+ dan bola yang lebih besar mewakili ion Cl-. (c) Kristal NaCl.
Agar senyawa ionik menjadi netral secara listrik, jumlah muatan pada kation dan anion di setiap satuan rumus harus nol. Jika muatan pada kation dan anion berbeda secara numerik, kita menerapkan aturan berikut untuk membuat rumus netral secara elektrik: Subskrip kation secara numerik sama dengan muatan pada anion, dan subskrip anion secara numerik sama dengan muatan pada kation. Jika muatan sama, maka tidak ada subskrip yang diperlukan. Aturan ini mengikuti dari fakta bahwa karena rumus senyawa ion biasanya rumus empirisnya, subskrip harus selalu disederhanakan menjadi rasio terkecil. Mari kita pertimbangkan beberapa contoh.
- Kalium Bromida. Kation Kalium K+ dan anion bromin Br- bergabung membentuk senyawa ionik kalium bromida. Jumlah dari muatan adalah +1 + (-1) = 0, jadi tidak ada subskrip yang diperlukan. Rumusnya adalah KBr.
- Seng Iodida. Kation seng Zn2+ dan anion yodium I- bergabung membentuk seng iodida. Jumlah dari muatan satu ion Zn2+ dan satu ion I- adalah +2 + (-1) = +1. Untuk membuat muatan menjadi nol kita mengalikan -1 muatan anion dengan 2 dan menambahkan subskrip "2" pada simbol untuk yodium. Oleh karena itu rumus untuk seng iodida adalah ZnI2
- Aluminium Oksida. Kationnya adalah Al3+ dan anionnya adalah oksigen O2-. Diagram berikut membantu kita menentukan subskrip untuk senyawa yang dibentuk oleh kation dan anion:
Jumlah muatan adalah 2(+3) + 3(-2) = 0. Jadi, rumus aluminium oksida adalah Al2O3.
Contoh 2.4
Tuliskan rumus magnesium nitrida, yang mengandung ion Mg2+ dan N3-.
Strategi
Panduan untuk menulis rumus senyawa ionik adalah netralitas listrik; yaitu, total muatan pada kation harus sama dengan total muatan pada anion. Karena muatan pada ion Mg2+ dan N3- tidak sama, kita tahu rumusnya tidak bisa MgN. Sebagai gantinya, kita menulis rumus sebagai MgxNy, di mana x dan y adalah subskrip yang akan ditentukan.
Solusi
Untuk memenuhi kenetralan listrik, hubungan berikut harus memiliki:
(+2)x + (-3)y = 0
Penyelesaian, kita mendapatkan x/y = 3/2. Maka x = 3 dan y = 2, ditulis:
Periksa Subskrip ini direduksi menjadi rasio bilangan bulat terkecil karena rumus kimia senyawa ionik biasanya adalah rumus empirisnya.
Logam natrium bereaksi dengan gas klorin membentuk NaCl
Ketika magnesium terbakar di udara, membentuk magnesium oksida dan magnesium nitrida.






No comments:
Post a Comment
Note: Only a member of this blog may post a comment.